
PRINCIPIOS CINÉTICOS
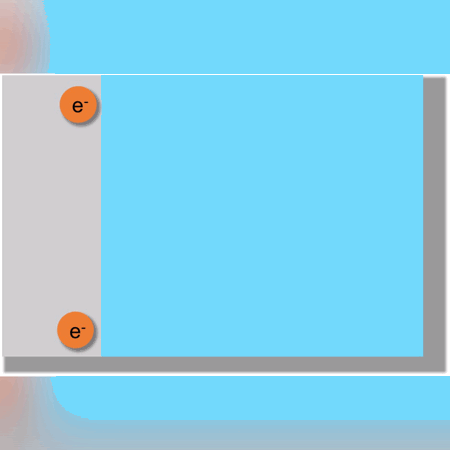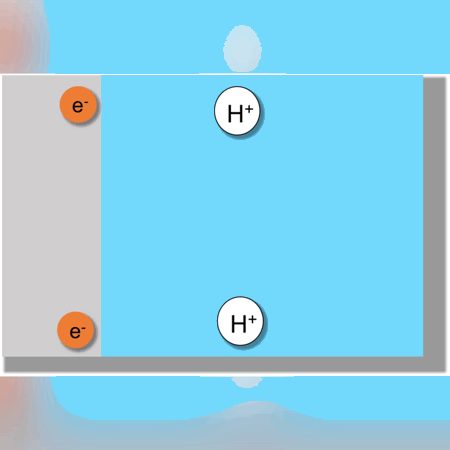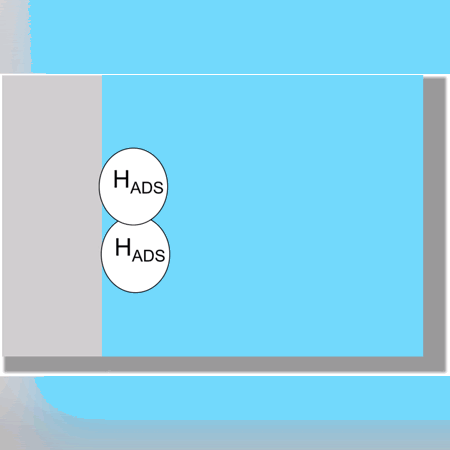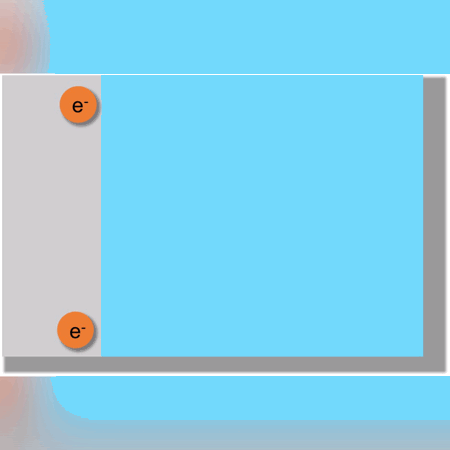


Otro ejemplo más complejo se observaría en la formación de Hidróxido de Sodio donde ocurren 4 reacciones vistas a continuación:
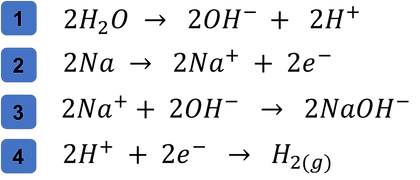

PRINCIPIOS CINÉTICOS
En las reacciones electroquímicas así como en todas las reacciones, la cinética depende de una constante de reacción, la cual va a dar una idea de la velocidad con que ocurren las reacciones. En todas las reacciones partimos de reactivos y obtenemos productos, y para cada reacción específica se tiene una constate de reacción, como se puede observar en la siguiente reacción:
La constante influye en la velocidad de la reacción y de dicha velocidad depende la cinética de la corrosión, donde la velocidad de la reacción siempre va a ser proporcional a la constante de la reacción y la relación de la concentración de los reactivos depende del orden de la reacción.
Si la reacción es de orden cero es independiente de la concentración de los reactivos, las de primer orden dependen de la concentración de los reactivos a la primera potencia y así sucesivamente.
Viendo la cinética de la reacción de manera global podemos decir que esta se relaciona con el transporte de las especies en la solución y con la velocidad específica de la reacción como tal.


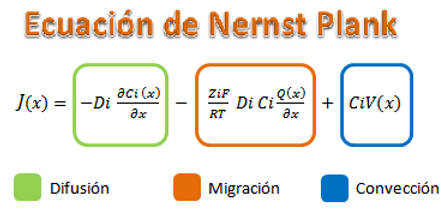
Cuando la velocidad de la reacción es mayor a la velocidad en que se transportan los reactivos hasta la superficie del electrodo, se dice que hay un control por transporte el cual esta modelado matemáticamente mediante:
Donde el flujo de materia es proporcional a la materia que se transporta por difusión, más lo que se tiene en el transporte por migración y finalmente el efecto que se tiene por convección el cual puede ser natural o forzado.
Cuando el transporte por difusión ocurre, se da por la diferencia de concentración que se tiene de las distintas especies en los diferentes lugares de la solución. Por ejemplo en un proceso de deposición en donde los iones que llegan a la superficie se transforman en metal, la concentración de estos seria igual a cero en la superficie del metal si consideramos que todos estos reaccionan generando así un frente difusional acercando los iones de este tipo. Este fenómeno ocurre muy comúnmente con la reacción catódica del oxigeno:
La fuerza motriz del transporte por migración es una diferencia de potencial, es decir, los iones se mueven por un campo eléctrico. En este caso los iones, moléculas o partículas que se mueven tienen que estar cargadas para sentir el efecto del campo eléctrico y entonces se tiene que los iones con carga positiva se acercan a los electrodos o superficies cargadas negativamente y los iones cargados negativamente al contrario, sintiendo repulsión por estos. Este campo eléctrico no solo afecta los iones de interés sino que afectan a todas las especies presentes que estén cargadas en la solución.
El último de los factores es la convección, se puede presentar de manera natural debido a efectos de diferencia de gravedad y densidad presentes en la solución o el de manera artificial llamada convección forzada donde el movimiento de la solución se realiza por un mecanismo externo.
Se tiene un caso típico de convección forzada en un flujo transportado en un sistema de tuberías donde se impulsan mediante el uso de bombas o en sistemas agitados con mezcladores en donde la convección ocurre por medio de las aspas. En todo caso la convección forzada tiende a homogeneizar la concentración en la solución, es decir, si tenemos un fenómeno difusional donde los iones tienen que llegar cada vez mas lejos hasta la superficie del electrodo esta distancia se reduciría mediante el fenómeno de convección.
Cuando la velocidad de la reacción es menor a la velocidad del transporte de las especies de la solución a la superficie del electrodo, se dice que hay un control cinético. Específicamente cuando hablamos de corrosión; el reactivo en la reacción anódica es el mismo material, por lo tanto no se requiere un transporte de este y así las reacciones suelen ocurrir por control cinético, este fenómeno esta modelado matemáticamente mediante:
Esta ecuación presenta varios aspectos que son relevantes:
la velocidad, que es expresada como la constante de reacción y es proporcional al exponente del sobrepotencial aplicado, donde a mayor sobrepotencial mayor constante de reacción y a la vez vemos que es inversamente proporcional con la temperatura.
Estos factores que se pueden manipular a la hora de realizar experimentos están presentes dependiendo de los sistemas corrosivos que se están estudiando y nos brindan una gran cantidad de información sobre los procesos corrosivos.

Efecto de la temperatura en la cinética de reacción

Efecto de la temperatura en la cinética de reacción

Efecto de la variación de corriente de intercambio en la cinética de reacción.

Efecto de la variación de corriente de intercambio en la cinética de reacción.

Efecto de la variación del numero de electrones involucrados en la cinética de la reacción

Efecto de la variación del numero de electrones involucrados en la cinética de la reacción